 |
|
 |
|
I. Historique :
|
1. Démocrite, philosophe, grec, (450-360 acn) : Invente le concept de l'atome : particule indivisible de matière |
|
2. John DALTON, chimiste, anglais, (1766-1844), en 1803 : reprend le théorie de Démocrite (particules infimes et indivisibles), mais compare ces particules à de petites billes. Tous les atomes d'un même élément sont identiques et les atomes sont différents d'un élément à l'autre. Ils ne sont pas altérés par les transformations chimiques. . |
|
3. William CROOKES, physicien, anglais, en 1879 : Il étudie le passage du courant électrique dans un tube à vide, il observe un rayonnement émis à la cathode se propageant en ligne droite en produisant une phosphorescence sur le verre. Il vient de mettre à jour l'existence des rayons cathodiques.
|
|
4. RÖNTGEN, physicien, allemand, (1895), découvre les rayons X. En entourant un tube cathodique de papier noir, il constate qu'un écran couvert de substance fluorescente s'éclaire à proximité du tube. Il en déduit donc que le tube émet un rayonnement capable de traverser des épaisseurs de matières considérables.
|
| 5. Henry BECQUEREL, physicien, français, (1896), découvre que les sels d'uranium émettent un rayonnement invisible même placé dans l'obscurité. Ces rayons, comme les rayons X traversent une feuille de papier noir mais également des plaques d'aluminium et une mince feuille de cuivre. |
|
6. THOMPSON, physicien, anglais, (1897), met en lumière que le rayonnement cathodique est constitué d'électrons. Il détermine la masse de celui-ci et découvre qu'elle est 1800 plus petite que celle de l'hydrogène. L'atome cesse d'être alors incassable, une plus petite particule le constituant ayant été découverte. |
|
7. 1898, Pierre et Marie CURIE analysent le minerai d'uranium et découvrent deux éléments radioactifs : le polonium et le radium. |
|
8. Ernest RUTHERFORD, physicien, anglais, (1871-1937) Il analyse la radioactivité et découvre trois sortes de rayonnements différents (alpha ++, bêta - et gamma). Il découvre aussi que lors de l'émission de rayons A et B, il y a une transmutation chimique. Enfin en 1911, il utilise les particules alpha pour sonder la matière et découvre que l'atome est constitué d'un noyaux formé de particules positives (protons), ce noyaux comprendrait presque la totalité de la masse de l'atome. Quant aux particules négatives (électrons) elles évoluerait à des distances relativement grandes créant ainsi un vide immense dans l'atome (si le noyaux de l'atome est représenté par une noix, et celle-ci placée au centre d'un terrain de foot, le premier électrons se trouverait sur la ligne de but du terrain ).
9. James CHADWICK, collaborateur de Rutherford, (en 1932) découvre le neutron, particule électriquement neutre et de masse voisine de celle du proton. Le noyau est alors constitué de neutrons et de protons, les électrons gravitant autour. Les particules constituant le noyau (protons et neutrons) sont alors appelées nucléons. |
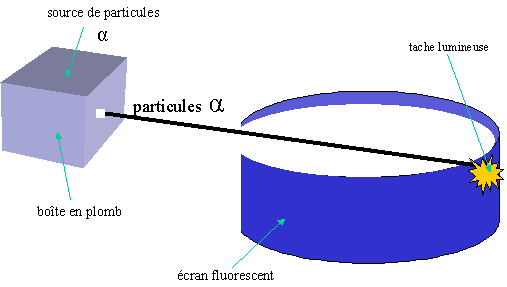
![]() L'expérience de Rutherford : Grâce à cette expérience, Ernest
Rutherford et ses collaborateurs ont pu mettre en évidence une propriété
importante des atomes, ils sont en majorité composés de vide. En utilisant les
particules alpha émises que certains corps radioactifs émettent, ils ont pu créer
un "pistolet" à rayon alpha. Le faisceau ainsi créé est
ensuite dirigé vers un écran fluorescent circulaire. Lorsqu'il n'y a pas de
corps solide entre le faisceau et l'écran, une seule tache lumineuse apparaît
exactement au point d'impact des particules alpha.
L'expérience de Rutherford : Grâce à cette expérience, Ernest
Rutherford et ses collaborateurs ont pu mettre en évidence une propriété
importante des atomes, ils sont en majorité composés de vide. En utilisant les
particules alpha émises que certains corps radioactifs émettent, ils ont pu créer
un "pistolet" à rayon alpha. Le faisceau ainsi créé est
ensuite dirigé vers un écran fluorescent circulaire. Lorsqu'il n'y a pas de
corps solide entre le faisceau et l'écran, une seule tache lumineuse apparaît
exactement au point d'impact des particules alpha.
Lorsque l'on place un corps (ici une mince feuille d'or d'épaisseur 1.10-3m), l'on peu observer la même tache d'impact mais également d'autre point d'impact (tâches lumineuses). Ce qui signifie donc que certaines particules sont déviées ou heurtent quelque chose alors que la majorité ne sont pas déviées.
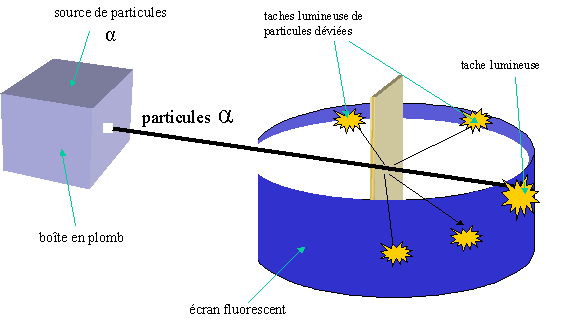
L'on peut donc en conclure que la majorité d'un atome est composé de vide. Et c'est à cette conclusion qu'aboutirent Rutherford et ses collaborateurs.