 |
|
 |
|
I. Constitution de la matière :
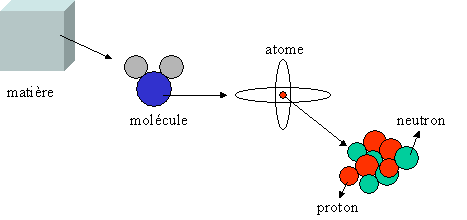
La matière est constituée de molécules, constituées elles-même d'atomes. ces atomes sont composés d'un cortège d'électron (de charge négative) et d'un noyau. Ce noyau est constitué de nucléons : protons (particules chargées positivement) et de neutrons (particules électriquement neutre).
Le noyau est donc une accumulation dans un volume restreint de charges positives, or celles-ci sont censées se repousser. Il y a donc quelque chose qui empêche ces particules de se repousser. Il s'agit de forces : les forces nucléaires.
Caractéristiques des forces nucléaires :
|
La masse de l'électron est environ 1800 plus petite que celle d'un nucléon. Un atome se représente comme suit :
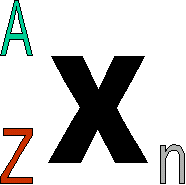 |
A = nombre de masses ( nombre de nucléons dans le noyau de
l'atome s'obtient en faisant l'arrondi de la masse relative)
Z = nombre de protons (numéro atomique) n = nombre de neutrons (s'obtient en faisant A-Z) |
exemples :
| un proton : |
un positron : |
| un électron : |
|
| un neutron : |
II. Les isotopes :
étymologie : ISOS : (grec) même, identique / TOPOS : lieu
définition : Isotope signifie par étymologie : même lieu. Ce sont en effet des éléments chimiques qui se retrouvent dans la même case que d'autres dans le tableau de Mendeleïev, car ils possèdent les mêmes propriétés chimiques que l'élément qui le représente.
exemple: l'hydrogène. Il existe d'autres éléments qui ont les mêmes propriétés chimiques que l'hydrogène. Ils ont le même nombre de protons et d'électrons, mais leurs nombres de neutrons sont différents.
 |
 |
 |
|
1H (élément le plus courant) |
2H (isotope 2 de l'hydrogène) |
3H (isotope 3 de l'hydrogène) |
Ces éléments ont les mêmes propriétés chimiques. En effet, ces propriétés sont déterminées par le nombre d'électrons et celui-ci reste identique. ATTENTION ! Ces éléments n'ont pas les mêmes propriétés physique (leur masse est déjà différente).